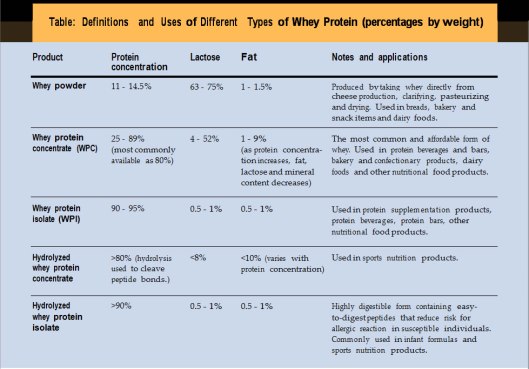
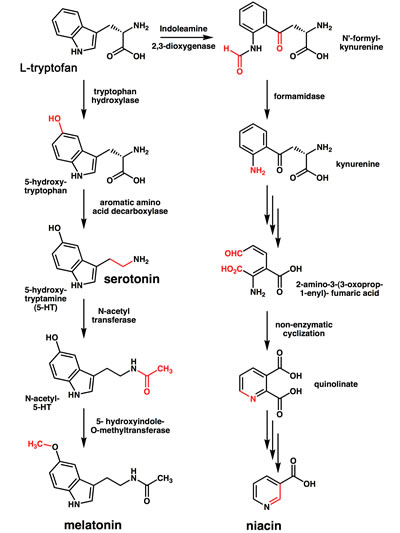
Faktasidan om Protein Whey och Whey Proteinpulver skriver om Vassleprotein och vassleproteinets effekter vid delar av det som brukar kallas metabolt syndrom: Fetma och Diabetes typ-2. Vassleprotein har uppenbara medicinska effekter mot symptombilderna, åtminstone på kort sikt.
Även faktaportalen om ADHD och ADD tar upp effekterna av Whey vid diabetes och att diabetes typ 2 kan botas.
I en nyligen publicerad rapport visas att det metabola syndromet med övervikt och diabetes typ-2 förefaller kunna mildras i symtomatologi och omfattning via en regelbunden konsumtion av Whey protein. Effektvägarna är flera, från att öka mättnadskänslan, öka termogenesis d.v.s. kroppens produktion av värme samt via en rad andra potentieringar av molekylära funktionsvägar exempelvis så visar Vassleprotein upp en glukossänkande och insulinotropisk effekt samt påverkar det kraftfulla reglersystemet.

Vassleprotein : Effekter på Diabetes typ-2
Slutsats Vassleprotein (Whey)
Vassleprotein utöver sin effekt via via bioaktiva peptider och aminosyror som genereras i magen under matsmältning och ökar frisättningen av flera hormoner, såsom CCK, PYY, GIP, GLP-1 och insulin vilka leder till minskat födointag och ökad mättnad (fig. 1). Insulin sekretion är associerad med glukossänkande effekt och med kontroll av födointag. Den mekanism genom vilken vassleproteiner leder till ökad insulinutsöndring är för närvarande inte känd och bör undersökas. En möjlig mekanism är produktionen av bioaktiva peptider som fungerar som endogena inhibitorer av DPP-4 i den proximala tarmen, förhindra nedbrytningen av den insulinotropiska inkretiner GLP-1 och GIP. En annan mekanism kan vara BCAA, speciellt leucin, vilket aktiverar mTOR signalvägar och proteinsyntes vilket leder till förhöjda hormon uttryck och sekretion samt en ökad termogenes. Den insulinotropiska effekten av vassleproteiner kan potentiellt dämpa postprandiala variationerna i blodglukosvärdet över dagen och kan därmed förbättra glukoshomeostas i typ 2-diabetes och kan möjligen skjuta upp införandet av medicinsk behandling. Förmågan att amplifiera insulinutsöndring genom vassleprotein kan vara säkrare än de vanligen använda terapeutiska medlen.
Den inducerade mättnadskänsla som vassleproteinet gav ökade också på termogenes och uppvisade dessutom en fullt förändringar i blodglukos fullt jämförbara med en läkemedelsbehandling vilket förefaller stödja tillämpningen av vassleprotein i den terapeutiska behandlingen av typ 2-diabetes och fetma. Icke desto mindre bör framtida studier avgöra om dessa gynnsamma effekter av vassleprotein på födointag och de subjektiva upplevelserna av mättnadkänsla efter intag hos människa också erhålls också vid ett långvarigt bruk med en daglig konsumtion av vassleprotein.
Förkortningar: GMP, glykomakropeptid, DPP-4, dipeptidylpeptidas-4, GIP, glukosberoende insulinotropisk polypeptid, GLP-1, glukagon-liknande peptid-1, BCAA, grenade aminosyror, PYY, peptid YY, CCK, kolecystokinin

Biokemiska och metaboliska mekanismer genom vilka vassleprotein i kosten kan bekämpa fetma och typ 2-diabetes
The Journal of Nutritional Biochemistry,Volym 24, Nummer 1, sidorna 1-5, januari 2013.
Abstrakt
1. Inledning
2. Vassleprotein komposition
3. Effekt av vassleprotein på termogenes
4. Insulinotropisk och glukossänkande effekt av vassleprotein
5. Effekt av vassleprotein på inkretiner system
5,1. Gastrisk hämmande peptid
5,2. Glukagon-liknande peptid-1 GLP-1
5,3. Dipeptidylpeptidas-4 (DPP-4)
6. Effekt av vassleprotein på aptit och hungerskänslor
6,1. Kolecystokinin
6,2. Peptid YY
6,3. Ghrelin
7. Slutsats
Referenser
Konsumtionen av mjölk och mejeriprodukter har förknippats med minskad risk för metabola sjukdomar och hjärt-kärlsjukdomar. Mjölk innehåller två primära proteinkällor, kasein (80%) och vassle (20%). Nyligen har de gynnsamma fysiologiska effekter av vassleprotein på kontroll av födointag och glukosmetabolismen rapporterats. Studier har visat en insulinotropisk och glukossänkande egenskaper vassleprotein hos friska och typ 2-diabetes patienter. Vassleprotein verkar inducera dessa effekter via bioaktiva peptider och aminosyror som genereras under dess mag matsmältning. Dessa aminosyror och peptider stimulerar frisättningen av flera tarmhormoner såsom kolecystokinin, peptid YY och inkretiner gastrisk hämmande peptid och glukagon-liknande peptid 1 som förstärker insulinutsöndring från β-celler och är förknippade med regleringen av födointag. De bioaktiva peptider genereras från vassleprotein kan också tjäna som endogena hämmare av dipeptidylpeptidas-4 (DPP-4) i den proximala tarmen och förhindrar inkretiner nedbrytning. Faktum nyligen var DPP-4-hämmare identifieras i hydrolysat vassleprotein. Denna översyn kommer att fokusera på de nya egenskaper vassleprotein och dess potentiella kliniska ansökan om fetma och typ 2-diabetes.

1. Inledning
Fetma förknippas med många metabola och ätstörningar, såsom frukost hoppar och överätande på natten, som resulterar i dålig följsamhet till de flesta dieter viktminskning. Därför, de flesta försök leder till initial viktminskning följt av snabb viktökning. Dessutom ökade kost-inducerade viktminskning resulterar i olika förändringar, såsom kolhydrater tillbakadragande, hungerkänslor och förändringar i tarm hormon som kan öka tillbakadragande från kosten. Dock kan viktminskning resultat kan förbättras genom strategier som leder till att minska hunger och / eller öka mättnad. En sådan strategi skulle kunna vara att använda anorektiska läkemedel. Men säkrare alternativ, såsom mättande mat, föredrog.
Nyligen har vi visat att timingen av måltiderna och sammansättning, nämligen ökad kolhydrater och protein till frukost, leda till framgångsrik viktminskning och dess underhåll genom att minska kompenserande förändringar i hunger, sug och ghrelin nivåerna. Dessa resultat överensstämmer med tidigare studier som visar att viktminskningen var större med hög-protein diet som leder till en hög termogen effekt, ökad mättnad och tarm hormon jämfört med isoenergetic intag av fett och kolhydrater,,. Även protein konsumtion är mättande, vissa proteinkällor främja ökad mättnadskänsla. Mjölk har fått stor uppmärksamhet som nuvarande data tyder på att låg fetthalt mjölk och mjölkprodukter konsumtion har positiva effekter på förebyggande eller behandling av fetma och typ 2-diabetes. Denna positiva association har fått forskare att studera effekterna av mjölkkomponenter. En av mjölkkomponenter, vassleprotein, har nyligen fått stor uppmärksamhet på grund av dess positiva effekter på energibalansen, aptit och glukosmetabolismen och potentiella ansökan för behandling av fetma och typ 2-diabetes.

2. Vassleprotein komposition
Vassleprotein utgör endast cirka 20% av totalt mjölkprotein, medan kasein utgör den största delen, ungefär 80% av totalt protein i mjölk. Under mjölk bearbetning, till kaseinerna ansvarar för att ostmassa, medan vassle är löslig. De olika proteinerna i vassla i ordning överflöd är β-laktoglobulin, α-laktalbumin, proteospepton, immunoglobuliner, bovint serumalbumin, laktoferrin och laktoperoxidas. Vassleprotein innehåller också glykomakropeptid (GMP), som är närvarande i vassle på grund av verkan av chymosin (rennin) på kasein i det första steget av den enzymatiska osttillverkningsprocessen. GMP är en utmärkt källa av grenade aminosyror (BCAA).
Inte bara är vassleprotein en god källa av aminosyror, men det är också en rik källa av bioaktiva peptider som genereras under dess matsmältning. Bioaktiva peptider av vassleprotein relä deras effekt genom att binda till specifika receptorer i tarmlumen före absorption eller i målorgan efter absorption in i blodomloppet. Peptider kortare än fyra rester kan korsa intercellulära korsningar och nå blodomloppet, medan större peptider kan transporteras via peptid transportör-medierad transportsystem. Graden av transporten bestäms av deras känslighet för borsta gränserna peptidaser. Flera bioaktiva peptider har isolerats, såsom de som hämmar angiotensinomvandlande enzym eller de med antimikrobiella och immunmodulerande aktiviteter. Dock bör mer arbete att investeras i att identifiera bioaktiva peptider med metabola aktiviteter.
3. Effekt av vassleprotein på termogenesis
Protein anses stimulera energiförbrukningen och att ha en större termogen effekt i den postprandiala perioden än antingen kolhydrater eller fetter. I kliniska prövningar, visade det sig att energikostnaden för smälta, absorbera och metaboliserande proteiner är större än kolhydrater eller fett,. Intressant nog har vassleprotein nyligen visats framkalla en större termogen respons än protein bestående av antingen kasein eller soja. Ökad proteinsyntes har föreslagits som en möjlig mekanism som ansvarar för den ökade termogenes. I själva verket var andelen proteinsyntesen efter vassle konsumtion två större än efter kasein förbrukning. Den höga halten leucin i vassleprotein (50-75% mer än andra proteinkällor) kan relateras till dess förmåga att stimulera proteinsyntesen, vilket kan förklara dess termogen effekt. Leucin inte bara fungerar som ett substrat för proteinsyntesen, men vid höga koncentrationer är det också upp-reglerar mammalian target of rapamycin (mTOR) signalering,. mTOR är ett serin / treonin-kinas, vars vägen är aktiverad, beroende på både ribosomalt protein S6-kinas 1 (S6K1) och eukaryot initiering faktor (eIF) 4E protein (4E-BP1) fosforylering, två proteiner inblandade i initiering av proteinsyntes. Dessutom, visades det att leucin-behandlade muskelceller hade reducerad adenosinmonofosfat (AMP) / adenosintrifosfat (ATP)-förhållande och minskad aktivitet av AMP-aktiverat proteinkinas (AMPK), en sensor av cellulär energi status. AMPK aktivering av 5-aminoimidazol-4-karbox-amid 1-beta-D-ribonukleosid (AICAR), förhindrade fosforylering av 4E-BP1, S6K1, S6 och eIF4G svar på leucin antyder minskad mTOR aktivitet.
Den postprandiala hastigheten för proteinsyntesen beror också på hastigheten av protein absorption. Snabb absorberande protein har en anabol effekt. Kasein och vassle har olika effekt på plasmakoncentrationer aminosyror profiler. Medan vassleprotein går snabbt genom magen utan matsmältningen, är frisättningen av kasein från magen försenade och ned till peptider. Den sura pH i magsäcken leder till kasein utfällning och exponering för gastrisk hydrolys, medan den lösliga vassle förblir mestadels intakt. Som ett resultat, är vassleprotein betraktas som snabb lättsmält protein med en hög och snabb aminosyraprofil, medan kasein har karakteriserats som långsamt protein leder till fördröjd magtömning och långsammare och lägre aminosyraprofil. Således plasma aminosyrakoncentrationer faller 100 min efter vassle intag men förblir förhöjda även 300 min efter kasein intag. Den snabba absorptionen av vassleprotein, vilket leder till ökade nivåer av leucin och andra grenade aminosyror och, som ett resultat, kan mTOR signaleringsaktivering och proteinsyntes stå för den större termogenes genereras efter matsmältning.
4. Insulinotropisk och glukossänkande effekten av vassleprotein
Det är allmänt accepterat att lågt glykemiskt index (GI) kost kan vara skyddande mot typ 2-diabetes, och att tillsats av protein i livsmedel minskar GI. Proteiner varierar i deras förmåga att minska postprandial hyperglycemi. Mjölkproteiner har visats stimulera insulinutsöndring. Men vassleproteiner visa sig vara mer insulinotropisk jämfört med kasein eller andra djur och växter proteiner. Tillsatsen av vassle-protein, minskad postprandiell hyperglykemi i ett dosberoende sätt, när de läggs till en drink av 50 g glukos. Denna dosberoende effekt av vassleprotein uppnåddes även när akut tillämpa olika mängder vassleprotein före eller tillsammans med höga måltider kolhydrater test. Mängder högre än 20 g per portion ledde till uttalade effekter sänka blodglukos och ökade insulinnivåer. Långsiktiga effekter hos överviktiga / feta vuxna har visat att efter 12 veckors vassleprotein intag (54 g / dag), plasmaglukos vid fasta insulinnivåer minskade med 11% och homeostasmodellen för bedömning av insulinresistens poäng med 10% jämfört med utgångsvärdet [30 ] tyder långsiktig förbättring av insulinkänslighet. I själva verket visade det sig hos friska försökspersoner som intag av ett aminosyror blandning av leucin, isoleucin, valin, lysin och treonin resulterade i blodglukos-och insulinnivåer liknande dem efter vassle intag men med en minskad storlek. Den sänkning av blodglukos och insulinotropa effekten av vassleprotein förekommer inte bara hos friska människor, men också i typ 2-diabetes,. Särskilt i typ 2-diabetes, visade det sig att tillsatsen av vassle till en måltid som innehåller snabbt ned och absorberas kolhydrater stimulerade högre plasmakoncentrationer insulin (+57% efter lunch) och minskad postprandiell blodglukos (-21% efter 120 min) [33 ].
Det är inte känt hur vassleprotein leder till ökad utsöndring av insulin. Emellertid kan den höga halten av essentiella aminosyror släppts efter vassleprotein matsmältningen vara medlare av sin insulinotropisk svar. I synnerhet, har leucin, isoleucin, valin, lysin och treonin föreslagits som de mest troliga aminosyrorna ansvarar för ökningen ses i insulinkoncentrationer. Leucin stimulerar insulinutsöndring från pankreatiska β antingen genom dess deaminerade metabolit, alfa-ketoisocaproic syra (KIC) eller genom att öka oxidationen av glutamat genom allosteriskt aktivera glutamatdehydrogenas,. Båda vägar leder till ökade ATP-nivåer och hämning av KATP kanalens aktivitet. Det är också trott att leucin eller KIC hämmar KATP kanalaktivitet direkt. Hursomhelst, leder hämning av KATP-kanaler till depolarisation av β cellmembranet, en ökning av fri cytosoliskt Ca2 + och frisättningen av insulin. Förhöjda ATP-nivåer kan också åstadkommas genom upp-reglerat uttryck av ATP-syntas β-subenheten, visat vara förmedlad av leucin,. Dessutom, såsom nämnts ovan, leucin och andra BCAA aktivera mTOR-vägen som leder till ökad proteinsyntes och specifikt β-cell insulin. Vissa, ännu okända, mTOR-oberoende vägar möjligen också spela en roll.
5. Effekt av vassleprotein på inkretiner systemet
Förutom effekten av vassla aminosyror på insulinutsöndring, inkretinhormoner frigörs från tarmen verkar också vara inblandade, i synnerhet, gastrisk inhiberande peptid (GIP) och glukagon-liknande peptid 1 (GLP-1).
5,1. Gastrisk hämmande peptid
GIP, även känd som glukos-beroende insulinotropisk peptid, frisätts från K-celler i duodenum efter födointag. Färska studier visar att en vassle drink orsakade en avsevärt förbättrad GIP svar (+80%) hos friska försökspersoner, medan grenade aminosyror blandningar inte. Hydrolysat erhållna från antingen vassle eller kasein-protein framkallade omkring 50% mer gastrisk sekretion än hela proteinlösningar som tillsammans med ökad GIP i plasma under de första 20 min av magtömning. Det är möjligt att bioaktiva peptider och / eller andra aminosyror frigjorda under vassle matsmältningen är de primära stimulatorer av GIP syntes och utsöndring, såsom konstaterades för insulin. En annan möjlighet är att bioaktiva peptider frisatta från vassleprotein kan leda till ökad halveringstid av GIP såsom kommer att förklaras senare.
5,2. Glukagon-liknande peptid-1
Jämfört med kasein eller soja, utlöste vassle den starkaste responsen av GLP-1 hos friska försökspersoner,. Minskade dock plasma GLP-1 koncentrationer avsevärt 2 timmar efter administrering av isoenergetic vassle, vasslepulver hydrolysat och kaseinhydrolysat lösningar, men fortsatte att öka förrän kasein-lösning, upprepa effekten av kasein långsam matsmältning, som diskuterades ovan. Den stimulerande effekten av vassleprotein är särskilt viktigt eftersom det visades att GLP-1-utsöndring efter både blandad måltid och oral glukos reduceras i typ 2-diabetes. Den försämring av GLP-1-utsöndring i typ 2-diabetes är relaterad till graden av hyperglykemi. Faktum patienter med sämre reglerad glykemisk kontroll uppvisar minskad GLP-1-utsöndring, vilket framgår av de höga glykosylerat hemoglobin. Den stimulerande effekten av vassleprotein på GLP-1 kan ha många positiva effekter inte bara på ökningen av glukos-inducerad insulinsekretion och minskning postprandial glykemi. Förbättrade GLP-1-nivåer ökar också syntesen av pro-insulin och insulin butiker i β-celler, främjar differentiering av prekursorceller till β-celler, leder till proliferation av β-cellinjer resulterar i ökad β-cellmassan, och minska andelen β-cell apoptos,,,. GLP-1 effekter medieras via signalering av GLP-1-receptorn i β-celler genom cAMP och proteinkinas A (PKA) aktivering. När det gäller insulin uttryck, GLP-1 involverade i regleringen av PDX-1, den mest studerade insulin transkriptionsfaktor, genom att öka dess protein nivåer och translokation till kärnan, följt av dess bindning till insulin-promotorn och ökad transkription. Dessutom leder PKA fosforylering av KATP-kanalen till dess stängning och efterföljande depolarisation av β cellmembranet, en ökning av fri cytosoliskt Ca2 + och frisättningen av insulin, såsom beskrivits ovan. GLP-1 saktar också magtömningen leder till minskad aptit, ökad mättnad, och, som ett resultat, viktminskning. Det är anmärkningsvärt att när vassle ingick i måltiden, minskade blodsockernivåer med 21% efter 180 minuter. Nedgången var i samma storleksordning som rapporterades för nateglinid, en ny snabbverkande icke-sulfonylurea insulinsekretagog, och liknande effekten av sulfonureider glipizid och glyburid på postprandiala nivån av plasmaglukos minskning efter flera månaders behandling [54 ]. Dessa resultat visar att vassleprotein är jämförbar i sitt glukossänkande effekt till vissa läkemedel som förskrivs. Som med GIP kan de ökade GLP-1-nivåer ses efter vassle intag resultera från bioaktiva peptider frigörs från vassleprotein som ökar GLP-1 halveringstid (se nedan).
5,3. Dipeptidylpeptidas-4 (DPP-4)
DPP-4 är den huvudsakliga enzym som ansvarar för den snabba nedbrytningen av inkretiner GLP-1 och GIP in vivo. DPP-4 existerar som en cell membranöverspännande enzym på talrika celltyper, och som en löslig cirkulerande form,. DPP-4 uttrycks starkt på endotelceller direkt intill inkretiner-utsöndrande celler i mag-tarmkanalen. Denna närhet leder till snabb spjälkning av GLP-1 och GIP snart efter deras frigivning. Höga nivåer av enzymet i cirkulationen kan tyda på att inkretiner kan försämras snabbare hos överviktiga än hos magra individer, var som rapporterats. Det visades att administrering av vassleprotein var associerad med en signifikant minskning av DPP-4-aktiviteten i den proximala tunntarmen. Rötning av vassleprotein genererar stora mängder av bioaktiva peptider och aminosyror kan fungera som kompetitiv DPP-4-hämmare. Faktum tripeptid (Ile-Pro-Ala) som ansvarar för måttlig DPP-4-hämning en nyligen identifierats i vassle β-laktoglobulin hydrolysat. Den inhiberande effekten av peptider frisatta från vassleprotein kan svara för den ökade halveringstiden av inkretiner GIP och GLP-1, och den därav följande insulinotropisk effekt. Uppenbarligen grundlig analys av vassleprotein, som en källa till DPP-4-hämmande peptider, är befogad.
6. Effekt av vassleprotein på aptit
Inte bara protein utgifter ökar energi, men det minskar också energiintag genom mekanismer som påverkar aptit kontroll. Även om det är inkonsekvent data från studier på människa, är det allmänt accepterat att proteiner är mer mättande än kolhydrater och fetter, men källan till protein kan spela en roll i dess mättande effekt. Mjölkproteiner har ansetts öka mättnadskänslan, men bidrag av kompletta mjölkproteiner vs vassleprotein eller kasein är fortfarande oklart. En studie fann liknande effekter på mättnad och födointag mellan vassleprotein och kasein. Andra studier har visat att vassleprotein har en starkare hämning av hunger och lägre födointag jämfört med kasein eller soja och äggalbumin,. Likaså visade det sig att medelvärdet energiintag var signifikant lägre med vassle måltid än med tonfisk, ägg och kalkon måltider i friska försökspersoner. I en senare långsiktig studie hos överviktiga och feta deltagare Det konstaterades också att tillskott med vassleprotein ledde till ökad mättnad jämfört med tillskott med sojaprotein eller kolhydrater. Det är troligt att vassle är mer mättande än kasein på grund av ökade plasma aminosyror och nivåer av plasma inkretiner, som beskrevs ovan. Såsom nämndes ovan, innehåller vassleprotein en hög koncentration av BCAA, särskilt L-leucin,. Leucin in i hjärnan snabbare än någon annan aminosyra. Det har nyligen visats att intracerebroventrikulär injektion av leucin är viktig för födointag undertryckande under 24 timmar, vilket antyder att vassleprotein kan utöva en central effekt på aptit. Förhöjning av diet-eller hjärnans leucin har visat sig undertrycka födointaget via en mekanism som involverar mTOR, AMPK och / eller BCAA metabolismen, såsom förklarats ovan. Leucin minskar födointaget via främja mTOR signalväg i hypotalamus, särskilt i regionen innehållande orexigenic neuroner uttrycker både neuropeptid Y och agouti-relaterat protein. Ytterligare forskning behövs för att fastställa effekten av vassleprotein på långsiktig mättnad.
Aminosyror befriade från vassleprotein under dess in vivo nedbrytning kan också stimulera frisättning av hormoner. Insulinutsöndring medieras av vassle förtäring kan direkt påverka regleringen födointaget genom att undertrycka aptiten och, som en följd påverkar kroppsvikten. I själva verket var insulinnivåerna stimuleras genom intag av vassle, förutom att modifiera glykemiskt svar, starkt förknippad med mättnad och minskat födointag,. Andra hormoner är också involverade i regleringen av födointag direkt i hypotalamus, som ghrelin, eller indirekt via vagusnerven, såsom kolecystokinin (CCK) och peptid YY (PYY).
6,1. Kolecystokinin
CCK är en väletablerad mättnad hormon inblandade i protein-inducerad födointag undertryckande. Vassleprotein ökar CCK koncentrationen i plasma, med en topp initialt 15-20 min efter måltiden och återstående högre än basala nivåer under mer än 3 timmar,. Vassle ökade CCK mer än kasein i en studie, men inte i en annan, på grund av sannolikt till graden av vassle rening och eventuellt skillnader i GMP innehåll.
6,2. Peptid YY
PYY är en gut hormon som utsöndras från L-celler genom hela längden av tarmen, men vid högre koncentrationer i de mer distala delarna. Det utsöndras postprandialt i förhållande till kalorier belastning och det beror på makronäringsämnen komposition. Koncentrationen av plasma PYY ökade efter intragastrisk administration av vassle eller kasein protein eller deras hydrolysat till friska försökspersoner. Effekten av vassle jämfört med andra proteiner på PYY sekretion kräver ytterligare utredning.
6,3. Ghrelin
Ghrelin är den enda orexigenic tarmhormon som kallas hittills släpps ut på marknaden från magen och dess koncentration vanligen når en topp strax före måltider och det undertrycks av intag av föda. Hos människor, vassleprotein och kalciumkaseinat eller andra proteinkällor, dvs soja och gluten, undertryckte ghrelin koncentrationer liknande laktos, men mer än glukos under 3 h,. Men i en nyligen genomförd studie fann man att fasta ghrelin var lägre i deltagarna konsumerar vassleprotein jämfört med soja eller kolhydrater. Minskad ghrelin sekretion skulle kunna förklara hunger dämpning efter vassle eller konsumtion av andra proteiner.
7. Slutsats
Vassleprotein via bioaktiva peptider och aminosyror som genereras under mag matsmältning, ökar frisättningen av flera hormoner, såsom CCK, PYY, GIP, GLP-1 och insulin, som leder till minskad födointag och ökad mättnad (fig. 1). Insulin sekretion är associerad med glukossänkande effekt och med kontroll av födointag. Den mekanism genom vilken vassleproteiner leder till ökad insulinutsöndring är för närvarande inte känd och bör undersökas. En möjlig mekanism är produktionen av bioaktiva peptider som fungerar som endogena inhibitorer av DPP-4 i den proximala tarmen, förhindra nedbrytningen av den insulinotropiska inkretiner GLP-1 och GIP. En annan mekanism kan innebära BCAA, speciellt leucin, som aktiverar mTOR signalväg och proteinsyntes leder till förhöjd hormon uttryck och sekretion och ökad termogenes. Den insulinotropiska effekten av vassleproteiner potentiellt kan dämpa postprandiala utflykter blodglukos över dagen, kan förbättra glukoshomeostas i typ 2-diabetes och kan möjligen skjuta upp införandet av medicinsk behandling. Förmågan att amplifiera insulinutsöndring genom vassleprotein kan vara säkrare än de vanligen använda terapeutiska medlen. Den inducerade mättnadskänsla, ökad termogenes och jämförbar storlek av blodglukos reduktion till läkemedelsbehandling stödja tillämpningen av vassleprotein i den terapeutiska behandlingen för förvaltningen av typ 2-diabetes och fetma. Icke desto mindre bör framtida studier avgöra om dessa gynnsamma effekterna av vassleprotein på födointag, subjektiva mättnad och intag hos människa erhålls från långvarig vassleprotein dagliga konsumtion.
Wing RR, Hill JO. Successful weight loss maintenance. Annu Rev Nutr. 2001;21:323–341
Sumithran P, Prendergast LA, Delbridge E, Purcell K, Shulkes A, Kriketos A, et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med. 2011;365:1597–1604
Vander Wal JS, Gupta A, Khosla P, Dhurandhar NV. Egg breakfast enhances weight loss. Int J Obes (Lond). 2008;32:1545–1551
Jakubowicz D, Froy O, Wainstein J, Boaz M. Meal timing and composition influence ghrelin levels, appetite scores and weight loss maintenance in overweight and obese adults. Steroids. 2012;77:323–331
Layman DK, Evans EM, Erickson D, Seyler J, Weber J, Bagshaw D, et al. A moderate-protein diet produces sustained weight loss and long-term changes in body composition and blood lipids in obese adults. J Nutr. 2009;139:514–521
Halton TL, Hu FB. The effects of high protein diets on thermogenesis, satiety and weight loss: a critical review. J Am Coll Nutr. 2004;23:373–385
Westerterp-Plantenga MS, Nieuwenhuizen A, Tome D, Soenen S, Westerterp KR. Dietary protein, weight loss, and weight maintenance. Annu Rev Nutr. 2009;29:21–41
Hall WL, Millward DJ, Long SJ, Morgan LM. Casein and whey exert different effects on plasma amino acid profiles, gastrointestinal hormone secretion and appetite. Br J Nutr. 2003;89:239–248
Tremblay A, Gilbert JA. Milk products, insulin resistance syndrome and type 2 diabetes. J Am Coll Nutr. 2009;28(Suppl 1):91S–102S
Krissansen GW. Emerging health properties of whey proteins and their clinical implications. J Am Coll Nutr. 2007;26:713S–723S
Madureira AR, Tavares T, Gomes AM, Pintado ME, Malcata FX. Invited review: physiological properties of bioactive peptides obtained from whey proteins. J Dairy Sci. 2010;93:437–455
Luhovyy BL, Akhavan T, Anderson GH. Whey proteins in the regulation of food intake and satiety. J Am Coll Nutr. 2007;26:704S–712S
Satake M, Enjoh M, Nakamura Y, Takano T, Kawamura Y, Arai S, et al. Transepithelial transport of the bioactive tripeptide, Val-Pro-Pro, in human intestinal Caco-2 cell monolayers. Biosci Biotechnol Biochem. 2002;66:378–384
Tappy L, Jequier E, Acheson K. Thermic effect of infused amino acids in healthy humans and in subjects with insulin resistance. Am J Clin Nutr. 1993;57:912–916
Acheson KJ, Ravussin E, Wahren J, Jequier E. Thermic effect of glucose in man. Obligatory and facultative thermogenesis. J Clin Invest. 1984;74:1572–1580
Acheson KJ, Blondel-Lubrano A, Oguey-Araymon S, Beaumont M, Emady-Azar S, Ammon-Zufferey C, et al. Protein choices targeting thermogenesis and metabolism. Am J Clin Nutr. 2011;93:525–534
Robinson SM, Jaccard C, Persaud C, Jackson AA, Jequier E, Schutz Y. Protein turnover and thermogenesis in response to high-protein and high-carbohydrate feeding in men. Am J Clin Nutr. 1990;52:72–80
Boirie Y, Dangin M, Gachon P, Vasson MP, Maubois JL, Beaufrere B. Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc Natl Acad Sci USA. 1997;94:14930–14935
Layman DK, Walker DA. Potential importance of leucine in treatment of obesity and the metabolic syndrome. J Nutr. 2006;136:319S–323S
Appuhamy JA, Knoebel NA, Nayananjalie WA, Escobar J, Hanigan MD. Isoleucine and leucine independently regulate mTOR signaling and protein synthesis in MAC-T cells and bovine mammary tissue slices. J Nutr. 2012;142:484–491
Li F, Yin Y, Tan B, Kong X, Wu G. Leucine nutrition in animals and humans: mTOR signaling and beyond. Amino Acids. 2011;41:1185–1193
Du M, Shen QW, Zhu MJ, Ford SP. Leucine stimulates mammalian target of rapamycin signaling in C2C12 myoblasts in part through inhibition of adenosine monophosphate-activated protein kinase. J Anim Sci. 2007;85:919–927
Pruznak AM, Kazi AA, Frost RA, Vary TC, Lang CH. Activation of AMP-activated protein kinase by 5-aminoimidazole-4-carboxamide-1-beta-D-ribonucleoside prevents leucine-stimulated protein synthesis in rat skeletal muscle. J Nutr. 2008;138:1887–1894
Mahe S, Roos N, Benamouzig R, Davin L, Luengo C, Gagnon L, et al. Gastrojejunal kinetics and the digestion of [15N]beta-lactoglobulin and casein in humans: the influence of the nature and quantity of the protein. Am J Clin Nutr. 1996;63:546–552
Karamanlis A, Chaikomin R, Doran S, Bellon M, Bartholomeusz FD, Wishart JM, et al. Effects of protein on glycemic and incretin responses and gastric emptying after oral glucose in healthy subjects. Am J Clin Nutr. 2007;86:1364–1368
Liljeberg Elmstahl H, Bjorck I. Milk as a supplement to mixed meals may elevate postprandial insulinaemia. Eur J Clin Nutr. 2001;55:994–999
Pal S, Ellis V. The acute effects of four protein meals on insulin, glucose, appetite and energy intake in lean men. Br J Nutr. 2010;104:1241–1248
Petersen BL, Ward LS, Bastian ED, Jenkins AL, Campbell J, Vuksan V. A whey protein supplement decreases post-prandial glycemia. Nutr J. 2009;8:47
Akhavan T, Luhovyy BL, Brown PH, Cho CE, Anderson GH. Effect of premeal consumption of whey protein and its hydrolysate on food intake and postmeal glycemia and insulin responses in young adults. Am J Clin Nutr. 2010;91:966–975
Pal S, Ellis V, Dhaliwal S. Effects of whey protein isolate on body composition, lipids, insulin and glucose in overweight and obese individuals. Br J Nutr. 2010;104:716–723
Nilsson M, Holst JJ, Bjorck IM. Metabolic effects of amino acid mixtures and whey protein in healthy subjects: studies using glucose-equivalent drinks. Am J Clin Nutr. 2007;85:996–1004
Ma J, Stevens JE, Cukier K, Maddox AF, Wishart JM, Jones KL, et al. Effects of a protein preload on gastric emptying, glycemia, and gut hormones after a carbohydrate meal in diet-controlled type 2 diabetes. Diabetes Care. 2009;32:1600–1602
Frid AH, Nilsson M, Holst JJ, Bjorck IM. Effect of whey on blood glucose and insulin responses to composite breakfast and lunch meals in type 2 diabetic subjects. Am J Clin Nutr. 2005;82:69–75
Floyd JC, Fajans SS, Conn JW, Knopf RF, Rull J. Stimulation of insulin secretion by amino acids. J Clin Invest. 1966;45:1487–1502
Gao Z, Young RA, Li G, Najafi H, Buettger C, Sukumvanich SS, et al. Distinguishing features of leucine and alpha-ketoisocaproate sensing in pancreatic beta-cells. Endocrinology. 2003;144:1949–1957
Smith TJ, Stanley CA. Untangling the glutamate dehydrogenase allosteric nightmare. Trends Biochem Sci. 2008;33:557–564
Yang J, Chi Y, Burkhardt BR, Guan Y, Wolf BA. Leucine metabolism in regulation of insulin secretion from pancreatic beta cells. Nutr Rev. 2010;68:270–279
Branstrom R, Efendic S, Berggren PO, Larsson O. Direct inhibition of the pancreatic beta-cell ATP-regulated potassium channel by alpha-ketoisocaproate. J Biol Chem. 1998;273:14113–14118
McTaggart JS, Clark RH, Ashcroft FM. The role of the KATP channel in glucose homeostasis in health and disease: more than meets the islet. J Physiol. 2010;588:3201–3209
Yang J, Wong RK, Park M, Wu J, Cook JR, York DA, et al. Leucine regulation of glucokinase and ATP synthase sensitizes glucose-induced insulin secretion in pancreatic beta-cells. Diabetes. 2006;55:193–201
Yang J, Wong RK, Wang X, Moibi J, Hessner MJ, Greene S, et al. Leucine culture reveals that ATP synthase functions as a fuel sensor in pancreatic beta-cells. J Biol Chem. 2004;279:53915–53923
Kazafeos K. Incretin effect: GLP-1, GIP, DPP4. Diabetes Res Clin Pract. 2011;93(Suppl 1):S32–S36
Calbet JA, Holst JJ. Gastric emptying, gastric secretion and enterogastrone response after administration of milk proteins or their peptide hydrolysates in humans. Eur J Nutr. 2004;43:127–139
Salehi A, Gunnerud U, Muhammed SJ, Ostman E, Holst JJ, Bjorck I, et al. The insulinogenic effect of whey protein is partially mediated by a direct effect of amino acids and GIP on beta-cells. Nutr Metab (Lond). 2012;9:48
Veldhorst MA, Nieuwenhuizen AG, Hochstenbach-Waelen A, van Vught AJ, Westerterp KR, Engelen MP, et al. Dose-dependent satiating effect of whey relative to casein or soy. Physiol Behav. 2009;96:675–682
Toft-Nielsen MB, Damholt MB, Madsbad S, Hilsted LM, Hughes TE, Michelsen BK, et al. Determinants of the impaired secretion of glucagon-like peptide-1 in Type 2 diabetic patients. J Clin Endocrinol Metab. 2001;86:3717–3723
Nauck MA, Vilsboll T, Gallwitz B, Garber A, Madsbad S. Incretin-based therapies: viewpoints on the way to consensus. Diabetes Care. 2009;32(Suppl 2):S223–S231
Brubaker PL, Drucker DJ. Minireview: glucagon-like peptides regulate cell proliferation and apoptosis in the pancreas, gut, and central nervous system. Endocrinology. 2004;145:2653–2659
Portha B, Tourrel-Cuzin C, Movassat J. Activation of the GLP-1 receptor signalling pathway: a relevant strategy to repair a deficient beta-cell mass. Exp Diabetes Res. 2011;376509;in press
Baggio LL, Drucker DJ. Biology of incretins: GLP-1 and GIP. Gastroenterology. 2007;132:2131–2157
Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest. 1998;101:515–520
Zander M, Madsbad S, Madsen JL, Holst JJ. Effect of 6-week course of glucagon-like peptide 1 on glycaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study. Lancet. 2002;359:824–830
Gribble FM, Manley SE, Levy JC. Randomized dose ranging study of the reduction of fasting and postprandial glucose in type 2 diabetes by nateglinide (A-4166). Diabetes Care. 2001;24:1221–1225
Kitabchi AE, Kaminska E, Fisher JN, Sherman A, Pitts K, Bush A, et al. Comparative efficacy and potency of long-term therapy with glipizide or glyburide in patients with type 2 diabetes mellitus. Am J Med Sci. 2000;319:143–148
Darmoul D, Voisin T, Couvineau A, Rouyer-Fessard C, Salomon R, Wang Y, et al. Regional expression of epithelial dipeptidyl peptidase IV in the human intestines. Biochem Biophys Res Commun. 1994;203:1224–1229
Hansen L, Deacon CF, Orskov C, Holst JJ. Glucagon-like peptide-1-(7-36)amide is transformed to glucagon-like peptide-1-(9-36)amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine. Endocrinology. 1999;140:5356–5363
Carr RD, Larsen MO, Jelic K, Lindgren O, Vikman J, Holst JJ, et al. Secretion and dipeptidyl peptidase-4-mediated metabolism of incretin hormones after a mixed meal or glucose ingestion in obese compared to lean, nondiabetic men. J Clin Endocrinol Metab. 2010;95:872–878
Gunnarsson PT, Winzell MS, Deacon CF, Larsen MO, Jelic K, Carr RD, et al. Glucose-induced incretin hormone release and inactivation are differently modulated by oral fat and protein in mice. Endocrinology. 2006;147:3173–3180
Tulipano G, Sibilia V, Caroli AM, Cocchi D. Whey proteins as source of dipeptidyl dipeptidase IV (dipeptidyl peptidase-4) inhibitors. Peptides. 2011;32:835–838
Bowen J, Noakes M, Trenerry C, Clifton PM. Energy intake, ghrelin, and cholecystokinin after different carbohydrate and protein preloads in overweight men. J Clin Endocrinol Metab. 2006;91:1477–1483
Baer DJ, Stote KS, Paul DR, Harris GK, Rumpler WV, Clevidence BA. Whey protein but not soy protein supplementation alters body weight and composition in free-living overweight and obese adults. J Nutr. 2011;141:1489–1494
Yudkoff M, Daikhin Y, Nissim I, Horyn O, Luhovyy B, Lazarow A. Brain amino acid requirements and toxicity: the example of leucine. J Nutr. 2005;135:1531S–1538S
Morrison CD, Xi X, White CL, Ye J, Martin RJ. Amino acids inhibit Agrp gene expression via an mTOR-dependent mechanism. Am J Physiol Endocrinol Metab. 2007;293:E165–E171
Figlewicz DP, Nadzan AM, Sipols AJ, Green PK, Liddle RA, Porte D, et al. Intraventricular CCK-8 reduces single meal size in the baboon by interaction with type-A CCK receptors. Am J Physiol. 1992;263:R863–R867
le Roux CW, Bloom SR. Peptide YY, appetite and food intake. Proc Nutr Soc. 2005;64:213–216 Williams DL, Cummings DE. Regulation of ghrelin in physiologic and pathophysiologic states. J Nutr. 2005;135:1320–1325
Bowen J, Noakes M, Clifton PM. Appetite regulatory hormone responses to various dietary proteins differ by body mass index status despite similar reductions in ad libitum energy intake. J Clin Endocrinol Metab. 2006;91:2913–2919

 Gustaf de Laval (1845-1913) var mannen från dalarna och hans uppfinning kallades för i folkmun för separatorn i Sverige. När apparaten gick i produktion och lanserades i England och USA så talades det vida och brett om fördelarna med Whey Protein Separatorn och det vi i Sverige kallar Vassleprotein – För Vassleprotein och Whey Protein samma sak som de flesta redan vet. Och en helt ny standard föddes för att kunna ta hand om alla Proteinerna från mjölk på ett effektivare och bättre sätt
Gustaf de Laval (1845-1913) var mannen från dalarna och hans uppfinning kallades för i folkmun för separatorn i Sverige. När apparaten gick i produktion och lanserades i England och USA så talades det vida och brett om fördelarna med Whey Protein Separatorn och det vi i Sverige kallar Vassleprotein – För Vassleprotein och Whey Protein samma sak som de flesta redan vet. Och en helt ny standard föddes för att kunna ta hand om alla Proteinerna från mjölk på ett effektivare och bättre sätt Och faktum att ända in i våra moderna tider så hänger kraften av den svenska uppfinningen kvar i form av företaget Alfa Laval som fortfarande separerar Whey Protein och därmed lägger grunden till att vi har Whey Proteinpulver (Vassleprotein Proteinpulver) som ett av de mest sålda kosttillskotten i våra hälsokostbutiker.
Och faktum att ända in i våra moderna tider så hänger kraften av den svenska uppfinningen kvar i form av företaget Alfa Laval som fortfarande separerar Whey Protein och därmed lägger grunden till att vi har Whey Proteinpulver (Vassleprotein Proteinpulver) som ett av de mest sålda kosttillskotten i våra hälsokostbutiker.  Den som vill läsa mer om Vassle Protein historia kan titta vidare hos Whey Proteinpulver där finns det gott om kosttillskott för sinnet om Proteinpulver historia.
Den som vill läsa mer om Vassle Protein historia kan titta vidare hos Whey Proteinpulver där finns det gott om kosttillskott för sinnet om Proteinpulver historia.